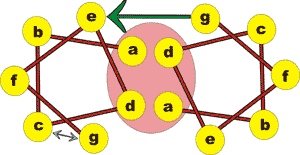
(siehe Abbildung 2 rosa Kreis a <--> d d <--> a)
Hydrophobe Bindungen sind streng genommen keine echten chem. Bindungen sondern Wechselwirkungen zwischen Kohlenwasserstoff-Gruppen ( wasserfliehende Bindungen zwischen nicht polaren (neutralen) Aminosäureresten wie z.B Analin, Leucin, Valin etc.) welche jedoch eine starke stabilisierende Wirkung auf das Dimer ausüben. Dadurch spielen sie auch eine wichtige Rolle in der Stabilität der Makrostruktur der Wollfaser.
Diese apolaren Seitenketten sind bestrebt in Gegenwart von Wasser, sich so eng wie möglich aneinanderzulagern, um dadurch das Wasser zu verdrängen. Was bedeutet, dass die Anzahl der Wassermoleküle, die diese Bindung umgeben können, kleiner wird.
Für das Filzen ist besonders von Interesse, dass die hydrophoben Bindungen in der mit Wasser gesättigten Wollfaser, durch organische Lösungsmittel, mechanische Beanspruchung und/oder Hitze gelöst und neu angeordnet werden können, so dass eine Fixierung (bzw. Formstabilität z.B. bei Hutkrempen) erreicht werden kann, die auch dem Wassergehalt der umgebenden Luft bei normaler Raumtemperatur standhält. ( Entsprechend wird die Beinflussung der hydrophoben Wechselwirkungen für sog. "Wollausrüstungsverfahren" genutzt z.B. für Bügelfalten durch "Dämpfen" und "Glatt-Trocknen". ) |
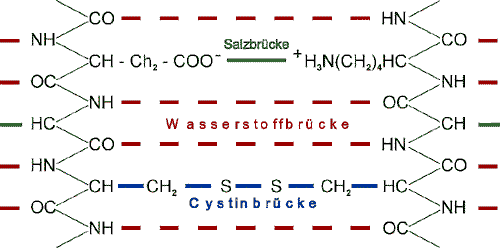
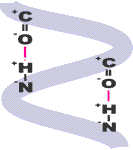 Die Wasserstoffbrücke ist eine Nebenvalenzbindung, d.h. eine eher schwache Bindung, deren Bindungsenergien ca. ein 1/10 derer einer Hauptvalenzbindung ausmachen. Jedoch ihr häufiges Vorkommen macht sie zu einer der wichtigsten Nebenvalenzkräfte. So trägt sie auch innerhalb der Peptidketten nicht unwesentlich zu deren Zusammenhalt bei. Zu einer solchen Brückenverbindung kommt es, wenn sich ein Sauerstoff- bzw. ein Stickstoffatom im näheren Bereich eines Wasserstoffatoms befindet
Die Wasserstoffbrücke ist eine Nebenvalenzbindung, d.h. eine eher schwache Bindung, deren Bindungsenergien ca. ein 1/10 derer einer Hauptvalenzbindung ausmachen. Jedoch ihr häufiges Vorkommen macht sie zu einer der wichtigsten Nebenvalenzkräfte. So trägt sie auch innerhalb der Peptidketten nicht unwesentlich zu deren Zusammenhalt bei. Zu einer solchen Brückenverbindung kommt es, wenn sich ein Sauerstoff- bzw. ein Stickstoffatom im näheren Bereich eines Wasserstoffatoms befindet 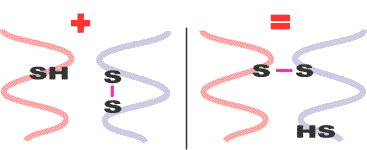 Wie bereits beschrieben ist das Cystin für den hohen Schwefelgehalt der Wolle verantwortlich, wodurch sich die Wollfaser von anderen Protein-fasern wie beispielsweise Seide unterscheidet. Bei der Aminosäre Cystin spricht man von einer doppelten Aminosäure, die zwei Schwefelstoffatome in einer Disulfidverbindung aufweist, dabei gehen zwei Cystin-Reste in einen Cystin-Rest über. Da es sich hier um eine Hauptvalenz- bzw. kovalente Atombindung handelt, ist sie auch in ihrer Bindungsenergie um ein vielfaches stärker als z.B. die Wasserstoffbrücken. Die sowohl inter- als auch intramolekular auftretenden Cystinbrücken tragen wesentlich zur Konformation der Peptidketten bei. Werden unter bestimmten Reaktionsbedingungen die Brücken zwischen den Peptidketten gegeneinander ausgetauscht
Wie bereits beschrieben ist das Cystin für den hohen Schwefelgehalt der Wolle verantwortlich, wodurch sich die Wollfaser von anderen Protein-fasern wie beispielsweise Seide unterscheidet. Bei der Aminosäre Cystin spricht man von einer doppelten Aminosäure, die zwei Schwefelstoffatome in einer Disulfidverbindung aufweist, dabei gehen zwei Cystin-Reste in einen Cystin-Rest über. Da es sich hier um eine Hauptvalenz- bzw. kovalente Atombindung handelt, ist sie auch in ihrer Bindungsenergie um ein vielfaches stärker als z.B. die Wasserstoffbrücken. Die sowohl inter- als auch intramolekular auftretenden Cystinbrücken tragen wesentlich zur Konformation der Peptidketten bei. Werden unter bestimmten Reaktionsbedingungen die Brücken zwischen den Peptidketten gegeneinander ausgetauscht