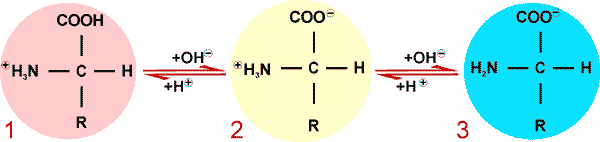
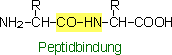
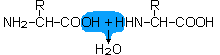Das resultierende Dipeptid-Molekül enthält je eine freie basische Aminogruppe und eine saure Carboxylgruppe wie die Aminosäuren aus denen es gebildet wurde. Folglich kann sich das Dipetid wiederum mit einer Aminosäure zu einem Tripeptid bzw. je ein Dipeptid-molekül zu einem Tetrapeptid fortentwickeln, wobei für jede Verbindung ein H2O-Molekül abgespalten wird. Die lateinische Vorsilbe bezeichnet jeweils die Anzahl der an der Peptidbindung beteiligten Aminosäuren. Bis auf die zwei Endgruppen (je eine basische Amino- und eine saure Carboxylgruppe) verlieren die restlichen beteiligten basischen- und sauren Gruppen ihre Ladungspotenziale und damit auch ihre Reaktionsfähigkeiten als freie Gruppen. Jedoch behalten die Aminosäurereste (R), die seitlich (Seitenketten), zur Längsachse der Peptidkette gesehen, herausragen, ihre, soweit vorhandenen, Reaktioinsfähigkeiten. Dies bedeutet, dass auch durch Reaktionen der basischen- (z.B Histidin, Lysin, Arginin) bzw. der sauren- (z.B. Asparaginsäure, Cystein, Tyrosin) aber auch anderer Aminosäurereste (z.B. Cystin, Serin) Zwitterionen gebildet werden können.
Tatsächlich ist der Aufbau einer Peptidkette aber nicht ganz so einfach erklärbar. Die Bestimmung der Reihenfolge (Sequenzierung) der Aminosäuren wird beispielsweise umso schwieriger je länger die einzelne Kette ist, wenn man bedenkt, dass die mittlere Länge einer Peptidkette, bei 24 verschieden-möglichen Aminosäuren, ca.600 Aminosäurereste beträgt. Je nach Lage und Distanz der Seitenketten innerhalb einer über Peptidbindung verknüpften Kette, aber auch zu benachbarten a-Helices unterscheidet man noch verschiedene wirksam werdende Bindungskräfte, die zur Synthese des komplizierten Wollproteins beitragen:
- Wasserstoffbrücken (polare Bindung)
- Cystinbrücken (auch Disulfid-Brücken)(kovalente Bindungen)
- Salzbrücken (ionische Bindungen)
- hydrophobe Bindungen (apolare Bindungen)
|